- ECHA
- Lagstiftning
- BPR
- Godkännande av biocidprodukter
- Förnyelse av nationellt tillstånd och ömsesidigt erkännande
- Inlämning av underlag
Inlämning av underlag
Inlämning av underlag
Ansökningarna om förnyat nationellt produktgodkännande, inräknat de som omfattas av eller beviljas genom ömsesidigt erkännande, ska lämnas in genom R4BP 3. En IUCLID-fil kan under vissa förhållanden begäras i enlighet med industrins handbok för inlämning 4a.
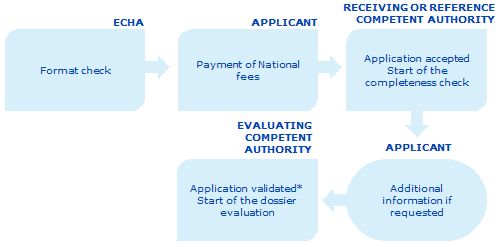
Här visas en översikt över processen för inlämning av registreringsunderlag.
Steg
Förnyelsen av nationellt produktgodkännande sker i flera steg. Varje steg måste ha genomförts innan ansökan kan gå vidare till nästa steg. Det är viktigt att sökanden ser till att alla relevanta tidsfrister hålls; annars kommer ansökan att avvisas under loppet av processen.
Echa kontrollerar att ansökan och uppgifterna har lämnats in i korrekt format.
Den behöriga myndigheten i den mottagande medlemsstaten samt, vid ömsesidigt erkännande, den behöriga myndigheten i referensmedlemsstaten och alla berörda behöriga myndigheter i medlemsstaten, informerar sökanden om de avgifter som ska betalas. Sökanden betalar dessa avgifter till den behöriga myndigheten / de behöriga myndigheterna i medlemsstaten inom 30 dagar från faktureringsdatum. Ansökan godtas formellt.
Om registreringsunderlaget anses ofullständigt kommer den behöriga myndigheten i referensmedlemsstaten eller i den mottagande medlemsstaten att begära in den information som saknas och ge sökanden rimlig tid (normalt inte längre än 90 dagar) att inkomma med de saknade uppgifterna.
Inom 30 dagar efter att den togs emot, eller inom 30 dagar från det datum då den begärda kompletterande informationen togs emot, ska den mottagande medlemsstaten eller referensmedlemsstaten validera ansökan.*
Utvärderingen av registreringsunderlaget inleds
Aktörer
De främsta aktörerna i processen för inlämning av registreringsunderlag är:
Den sökande
Den sökande ansvarar för kvaliteten på uppgifterna i sitt registreringsunderlag. Som sökande måste du lämna in information om din biocidprodukt antingen i form av ett registreringsunderlag eller genom ett tillstånd om tillgång. Om den behöriga myndigheten i medlemsstaten så begär måste du som sökande lämna in kompletterande information inom den fastställda tidsfristen. Som sökande måste du även lämna in ett utkast till sammanfattning av biocidproduktens egenskaper.
Echa
Echa ansvarar för att säkerställa att informationen i registreringsunderlagen är i korrekt format. Echa säkerställer även att inlämningsprocessen håller sig inom de fastställda tidsfristerna.
Behörig myndighet i mottagande medlemsstat
Den mottagande behöriga myndigheten ansvarar för att utvärdera det registreringsunderlag som sökanden lämnat in vid ett förnyat nationellt produktgodkännande.
Behörig myndighet i referensmedlemsstaten
Den behöriga myndigheten i referensmedlemsstaten ansvarar för att validera ansökningsunderlagen och utvärdera det registreringsunderlag som sökanden lämnat in vid ett förnyat ömsesidigt erkännande. Det kan vara en annan behörig myndighet i medlemsstaten än den som utvärderade det ursprungliga godkännandet (efter avtal).
Berörd behörig myndighet i medlemsstaten
De berörda behöriga myndigheterna ansvarar för att verifiera att ansökan som mottagits för förnyelse av det ömsesidigt erkända godkännandet omfattas av de kompletterande reglerna (enligt artikel 1.2 och 1.3 i förordning (EU) nr 492/2014).
*För att förnya ömsesidigt erkännande inom 30 dagar efter att den togs emot kommer den berörda medlemsstaten/de berörda medlemsstaterna att verifiera att den mottagna ansökan omfattas av de kompletterande reglerna enligt artikel 1.2 och 1.3 i kommissionens delegerade förordning (EU) nr 492/2014 (dvs. att beviljade godkännanden omfattas av samma bestämmelser och villkor, omfattas av begränsade undantag såsom information som kan bli föremål för en administrativ ändring). Om så inte är fallet måste ansökan om förnyelse behandlas enligt de normala förfarandena för förnyelse i artikel 31 i biocidförordningen.